उदाहरण : (i) लोहे पर जंग लगना
(ii) भोजन का पाचन
अभिकारक : ऐसे पदार्थ जो किसी रासायनिक अभिक्रिया में हिस्सा लेते हैं उन्हें अभिकारक कहते हैं।
उत्पाद : ऐसे पदार्थ जिनका निर्माण रासायनिक अभिक्रिया में होता है, उन्हें उत्पाद कहते हैं। उदाहरण :
CH4 + 2O2 → CO2 + 2H2O
रासायनिक समीकरण (Chemical Equation)
रासायनिक समीकरण एक संक्षिप्त रूप है, जो रासायनिक अभिक्रियाओं को अभिकारक और उत्पाद के रासायनिक सूत्रों के साथ व्यक्त किया जाता है।
रासायनिक समीकरण में पदार्थों की भौतिक अवस्थाएं लिखना
(s) = ठोस (Solid)
(l) = तरल (Liquid)
(g) = गैस (Gas)
(aq) = जल में घुला हुआ (Aqueous)
For example: Mg(s) + O2(g) → Mgo(s)
रासायनिक अभिक्रियाओं के प्रकार:
I. संयोजन अभिक्रिया
II. वियोजन अभिक्रिया
III. विस्थापन अभिक्रिया
IV. द्विविस्थापन अभिक्रिया
V. उपचयन एवं अपचयन
I. संयोजन अभिक्रिया: इस अभिक्रिया में दो या दो से अधिक अभिकारक मिलकर एक उत्पाद बनाते हैं।
A + B —> AB
उदाहरण :
(i) कोयले का दहन C(s) + O2(g) → CO₂(g)
(ii) जल का निर्माण 2H2(g) + O2(g) --> 2H₂O(l)
(iii) CaO(s) + H₂O(l) → Ca(OH)2(aq)
(बिना बुझा चूना). (बुझा हुआ चूना)
उष्माक्षेपी : अभिक्रिया जिन अभिक्रियाओं में उत्पाद के निर्माण के साथ-साथ ऊष्मा का भी उत्सर्जन होता है।
(i) प्राकृतिक गैस का दहन
CH4(g) + 2O2 (g) → CO2 (g) + 2H2O (g) + ऊर्जा
(ii) शरीर को ऊर्जा की आवश्यकता होती है, और यह ऊर्जा हमें भोजन से प्राप्त होती है। पाचन क्रिया के दौरान खाद्य पदार्थ जैसे चावल, आलू और ब्रेड में मौजूद कार्बोहाइड्रेट टूटकर ग्लूकोज़ (C₆H₁₂O₆) में परिवर्तित हो जाते हैं। यह ग्लूकोज़ तब शरीर की कोशिकाओं में उपस्थित आक्सीजन (O₂) के साथ मिलकर ऊर्जा प्रदान करता है।
C6H12O6(aq) + 6O2(aq) → 6CO2(aq) + 6H2O(l) + ऊर्जा
II. वियोजन अभिक्रियाः इस अभिक्रिया में एकल अभिकारक टूट कर दो या उससे अधिक उत्पाद बनते हैं।
AB → A + B
उदाहरण: चूना पत्थर (CaCO₃) का वियोजन:
यहां, चूना पत्थर ताप के प्रभाव से कैल्शियम ऑक्साइड (CaO) और कार्बन डाइऑक्साइड (CO₂) में टूट जाता है।
उष्माशोषी अभिक्रिया : वह रासायनिक अभिक्रिया होती है, जिसमें ऊर्जा (आमतौर पर ताप) अवशोषित होती है।
वियोजन अभिक्रिया के प्रकार:
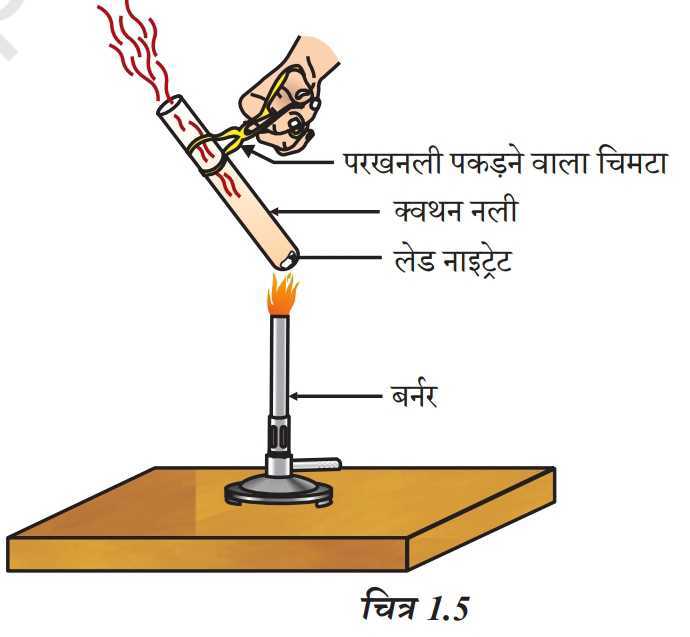
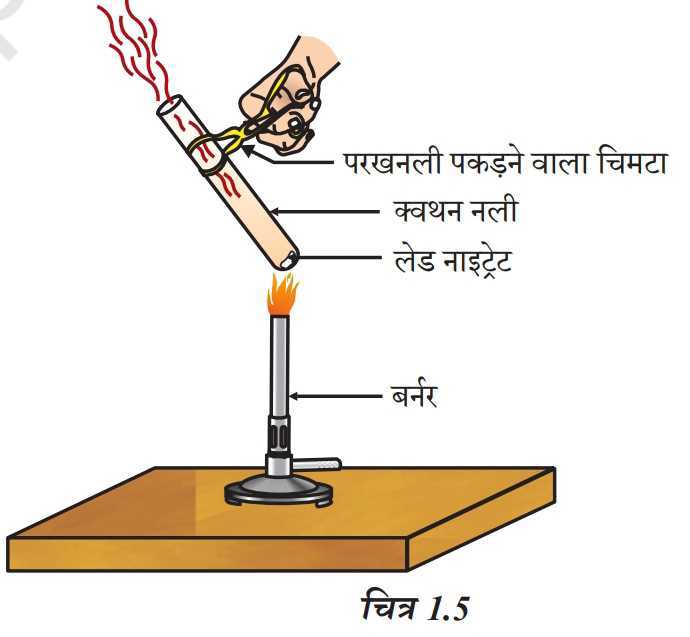
(i) ऊष्मीय वियोजन: ऊष्मा द्वारा किया गया वियोजन।
उदाहरण:
फेरस सल्फेट (हरा रंग) फेरिक आक्साइड (भूरा लाल रंग)
(लेड नाइट्रेट). (लेड ऑक्साइड) (नाइट्रोजन डाइऑक्साइड)
भूरा रंग का धुआं नाइट्रोजन डाइऑक्साइड (NO₂) का धुआं होता है।
(ii) वैद्युत वियोजन: विद्युत धारा प्रवाहित कर होने वाला वियोजन।
उदाहरण:
(iii) प्रकाशीय वियोजन: सूर्य के प्रकाश की उपस्थिति में होने वाला वियोजन।
उदाहरण:
इस अभिक्रिया का उपयोग श्याम-श्वेत फोटोग्राफी में होता है।
III. विस्थापन अभिक्रिया
इन अभिक्रियाओं में अधिक क्रियाशील तत्व कम क्रियाशील तत्व को उसके यौगिक से विस्थापित कर देता है।
उदाहरण:
Fe(s) + CuSO4(aq) → FeSO4(aq) + Cu(s)
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
यहां जिंक (Zn), लोहा (Fe), जो कि कॉपर (Cu) से अधिक क्रियाशील है, कॉपर सल्फेट (CuSO₄) से कॉपर (Cu) को विस्थापित कर देता है और फेरस सल्फेट (FeSO₄), जिंक सल्फेट (ZnSO₄) बनाता है।
क्रियाशीलता श्रृंखला (Reactivity Series):
लिथियम (Li)
पोटैशियम (K)
सोडियम (Na)
कैल्शियम (Ca)
मैग्नीशियम (Mg)
अल्यूमिनियम (Al)
जिंक (Zn)
लोहा (Fe)
टिन (Sn)
सीसा (Pb)
हाइड्रोजन (H)
कॉपर (Cu)
सिल्वर (Ag)
प्लैटिनम (Pt)
गोल्ड (Au)
IV. द्विविस्थापन अभिक्रियाः
इस अभिक्रिया में उत्पादों का निर्माण, दो यौगिकों के बीच आयनों के आदान प्रदान से होता है।
Na₂SO₄ (aq) + BaCl₂ (aq) → BaSO₄ (s) + 2NaCl (aq)
(सोडियम सल्फेट) (बेरियम क्लोराइड) (बेरियम सलफेट) (सोडियम क्लोराइड)
बेरियम सल्फेट (BaSO₄) के सफेद अविलेय अवक्षेप का निर्माण होता है। इसीलिए इस अभिक्रिया को अवक्षेपण अभिक्रिया भी कहते हैं।
V. उपचयन एवं अपचयन :
उपचयन :
(i) किसी पदार्थ में आक्सीजन की वृद्धि होना।
(ii) किसी पदार्थ में हाइड्रोजन का हास होना।
अपचयन :
(i) जब किसी पदार्थ में आक्सीजन का हास होता है।
(ii) जब किसी पदार्थ में हाइड्रोजन की वृद्धि होती है।
इस अभिक्रिया में कॉपर आक्साइड कॉपर में अपचयित हो जाता है। हाइड्रोजन उपचयित होकर जल बनता है। इस अभिक्रिया में उउपचयन तथा उपचयन दोनों हो रहे है, इसे रेडॉक्स अभिक्रिया कहते हैं।
दैनिक जीवन में उपचयन अभिक्रियाओं का प्रभाव :
संक्षारण (Corrosion)
जब कोई धातु हवा में उपस्थित ऑक्सीजन, नमी (आर्द्रता), अम्ल, या अन्य रासायनिक पदार्थों के संपर्क में आती है, तो उसकी ऊपरी सतह का धीरे-धीरे नष्ट होना या कमजोर हो जाना संक्षारण कहलाता है।
उदाहरण:
लोहे पर जंग लगना (Rusting of Iron)।
तांबे पर हरा रंग जमना (Copper turning green)
चांदी का काला पड़ना (Tarnishing of Silver)
रोकथाम के उपाय:
विकृतगंधिताः
वसायुक्त और तैलीय खाद्यसामग्री, वायु के सम्पर्क में आने पर उपचयित हो जाते हैं जिससे उनके स्वाद और गंध में परिवर्तन हो जाता है इसे विकृतगंधिता कहते हैं।
उदाहरण:
तैलीय चिप्स का खराब होना।
घी या तेल में अजीब गंध आना।
विकृतगंधिता रोकने के उपाय :





